Aus Emis.wiki
Karg (Diskussion | Beiträge) |
Karg (Diskussion | Beiträge) (→emis.mdr (Medical Device Regulation)) |
||
| Zeile 1: | Zeile 1: | ||
| - | = emis.mdr (Medical Device Regulation) = | + | = emis.mdr ("Medical Device Regulation") = |
| - | Mit dem emis.mdr Modul sind Sie in der Lage die derzeit geltenden komplexen MDR-Anforderungen abzudecken. Dieses Modul wurde extra für unsere Kunden entwickelt, welche im | + | Mit dem emis.mdr-Modul sind Sie in der Lage die derzeit geltenden komplexen MDR-Anforderungen abzudecken. Dieses Modul wurde extra für unsere Kunden entwickelt, welche im medizinischen Bereich tätig sind. |
| - | Im | + | Im nachfolgenden Schaubild können Sie entnehmen, wie sich die Anforderungen im Laufe der Jahre verändert haben. |
[[Image:1.png|400px|center]] | [[Image:1.png|400px|center]] | ||
| Zeile 9: | Zeile 9: | ||
== Artikelstamm == | == Artikelstamm == | ||
| - | Im emis.artikelstamm | + | Im emis.artikelstamm können Sie mit dem Button "MDR" die MDR-Informationen zum Artikel aufrufen. [[Image:3.png|center|200px|3.png]] |
In dieser Maske befinden sich folgende Informationen bzw. Funktionen: | In dieser Maske befinden sich folgende Informationen bzw. Funktionen: | ||
| Zeile 15: | Zeile 15: | ||
[[Image:0004.png|center|400px|004.png]] | [[Image:0004.png|center|400px|004.png]] | ||
| - | *Produkt UDI ( Unique Device Identification) | + | *Produkt-UDI ("Unique Device Identification") |
*Hersteller | *Hersteller | ||
| Zeile 24: | Zeile 24: | ||
**Wir sind Erstimporteur ja/ nein | **Wir sind Erstimporteur ja/ nein | ||
**Wenn ja: | **Wenn ja: | ||
| - | ***EUDAMED (Europäische Medizinproduktedatenbank) Reg. ja/ nein | + | ***EUDAMED ("Europäische Medizinproduktedatenbank") Reg. ja/ nein |
***MDR-Importeur-Vorgaben gemäß PR erfüllt und Festlegung Labelung ja/ nein | ***MDR-Importeur-Vorgaben gemäß PR erfüllt und Festlegung Labelung ja/ nein | ||
| - | *MDR-SRN ( | + | *MDR-SRN (Registrierungsnr. des Herstellers, alphanumerisch) |
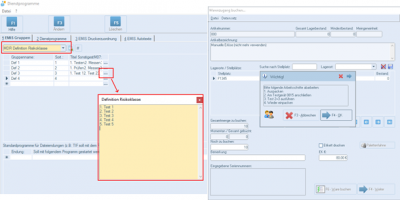
| - | *MDR Risikoklasse als | + | *MDR-Risikoklasse als Dropdown-Menü (Einträge können in den emis.dienstprogrammen festgelegt werden (Gruppe "MDR Risikoklasse"). |
*uvm. | *uvm. | ||
| Zeile 41: | Zeile 41: | ||
*Handelsfreigabe ja/ nein | *Handelsfreigabe ja/ nein | ||
| - | *IFU (Instruction for use) vorhanden - ja/ nein | + | *IFU ("Instruction for use") vorhanden - ja/ nein |
*Link zur aktuellen IFU (interner / und externer Link), Verknüpfung zur emis.dokumentenverwaltung. | *Link zur aktuellen IFU (interner / und externer Link), Verknüpfung zur emis.dokumentenverwaltung. | ||
| Zeile 55: | Zeile 55: | ||
Sollten Eingaben auf aktiv gesetzt und somit die Kriterien nicht erfüllt sein, wird der Verkauf (Lieferscheindruck) gesperrt. | Sollten Eingaben auf aktiv gesetzt und somit die Kriterien nicht erfüllt sein, wird der Verkauf (Lieferscheindruck) gesperrt. | ||
| - | <br> Außerdem können in der | + | <br> Außerdem können in der Dokumentenverwaltung zum Artikel folgende Dokumente abgelegt werden: |
*EU-Konf.E. | *EU-Konf.E. | ||
| Zeile 63: | Zeile 63: | ||
*Montageanleitungen | *Montageanleitungen | ||
| - | *interne | + | *interne Dokumente zum Qualitätsmanagement |
[[Image:7.png|center|7.png]] | [[Image:7.png|center|7.png]] | ||
| Zeile 69: | Zeile 69: | ||
== CRM == | == CRM == | ||
| - | + | Folgende Felder wurden in den kundenbezogenen Auftragsdaten für emis.mdr hinzugefügt. | |
[[Image:8.png|center]] | [[Image:8.png|center]] | ||
[[Image:9.png|right]] | [[Image:9.png|right]] | ||
| - | 1. Benannte Stelle Y, | + | 1. Benannte Stelle Y, gültig bis XX.XX.XXXX (Dropdown-Menü, Einträge können in den emis.dienstprogrammen festgelegt werden (Gruppe "MDR Bekannte Stelle"). |
2. QM-System gemäß EN 13485, gültig bis XX.XX.XXXX | 2. QM-System gemäß EN 13485, gültig bis XX.XX.XXXX | ||
Version vom 5. Mai 2021, 16:03 Uhr
Inhaltsverzeichnis |
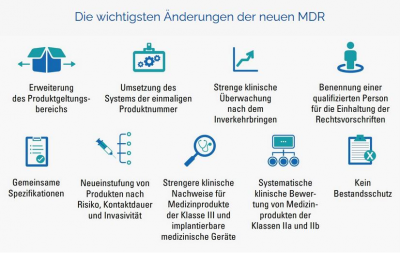
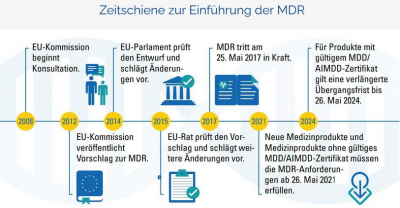
emis.mdr ("Medical Device Regulation")
Mit dem emis.mdr-Modul sind Sie in der Lage die derzeit geltenden komplexen MDR-Anforderungen abzudecken. Dieses Modul wurde extra für unsere Kunden entwickelt, welche im medizinischen Bereich tätig sind. Im nachfolgenden Schaubild können Sie entnehmen, wie sich die Anforderungen im Laufe der Jahre verändert haben.
Damit Sie die ab dem 26.05.2021 die geltenden MDR Anforderungen für Medizin-Produkte usw. mit emis abdecken können, haben wir das Modul emis.mdr mit einer Vielzahl an Funktionen, welche die erforderlichen Qualitätsregularien abfragen, ausgestattet.
Artikelstamm
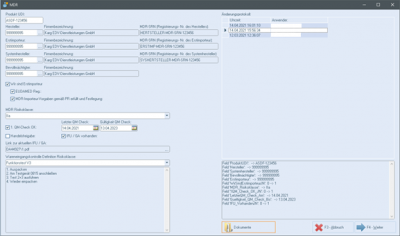
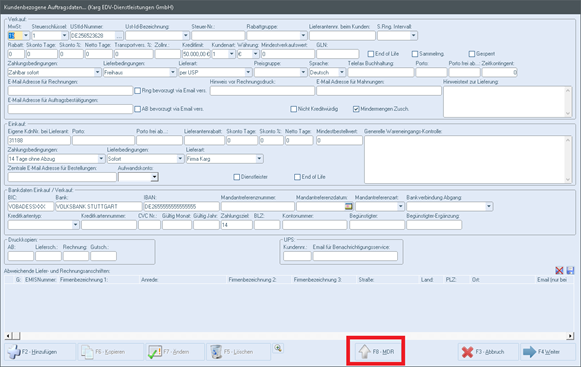
Im emis.artikelstamm können Sie mit dem Button "MDR" die MDR-Informationen zum Artikel aufrufen.In dieser Maske befinden sich folgende Informationen bzw. Funktionen:
- Produkt-UDI ("Unique Device Identification")
- Hersteller
- Bevollmächtigter
- Erstimporteur
- Wir sind Erstimporteur ja/ nein
- Wenn ja:
- EUDAMED ("Europäische Medizinproduktedatenbank") Reg. ja/ nein
- MDR-Importeur-Vorgaben gemäß PR erfüllt und Festlegung Labelung ja/ nein
- MDR-SRN (Registrierungsnr. des Herstellers, alphanumerisch)
- MDR-Risikoklasse als Dropdown-Menü (Einträge können in den emis.dienstprogrammen festgelegt werden (Gruppe "MDR Risikoklasse").
- uvm.
Wie wird definiert, ob das Produkt verkauft werden darf oder ob es gesperrt werden muss?
Dies erfolgt durch die Abfrage sämtlicher erforderlichen Qualitätsregularien, wie z. B.
- Gültigkeit (wenn überschritten, darf das Produkt nicht verkauft werden, das Produkt muss gesperrt werden).
- Handelsfreigabe ja/ nein
- IFU ("Instruction for use") vorhanden - ja/ nein
- Link zur aktuellen IFU (interner / und externer Link), Verknüpfung zur emis.dokumentenverwaltung.
- Wareneingangskontrolle Definition Risikoklasse
Zu beachten ist hier, dass bei allen genannten Feldern, die Eingaben mit Datum und dem entsprechenden Anwender dokumentiert werden!
Sollten Eingaben auf aktiv gesetzt und somit die Kriterien nicht erfüllt sein, wird der Verkauf (Lieferscheindruck) gesperrt.
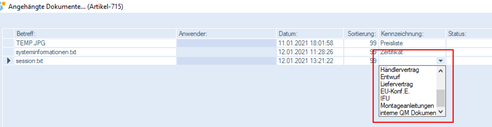
Außerdem können in der Dokumentenverwaltung zum Artikel folgende Dokumente abgelegt werden:
- EU-Konf.E.
- IFU
- Montageanleitungen
- interne Dokumente zum Qualitätsmanagement
CRM
Folgende Felder wurden in den kundenbezogenen Auftragsdaten für emis.mdr hinzugefügt.
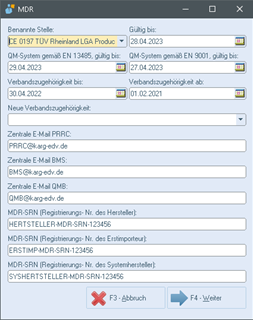
1. Benannte Stelle Y, gültig bis XX.XX.XXXX (Dropdown-Menü, Einträge können in den emis.dienstprogrammen festgelegt werden (Gruppe "MDR Bekannte Stelle").
2. QM-System gemäß EN 13485, gültig bis XX.XX.XXXX
3. QM-System gemäß EN 9001, gültig bis XX.XX.XXXX
4. Verbandszugehörigkeit bis: (Datumsfeld - automatische Wiedervorlage mit kontrollvariabler 2 Wochen vorher)
5. Verbandszugehörigkeit ab: (Datumsfeld - automatische Wiedervorlage mit kontrollvariabler 2 Wochen vorher, dazu ein Feld für die neue Verbandszugehörigkeit)
6. "Zentrale E-Mail PRRC:" Hier geht es um den Sicherheitsbeauftragter Medizinprodukte Hersteller
7. "Zentrale E-Mail BMS:" Hier geht es um den Sicherheitsbeauftragter Medizinprodukte Kunde
8. "Zentrale E-Mail QMB:"
9. MDR-SRN des Herstellers
10. MDR-SRN des Erstimporteurs
11. MDR-SRN des Systemherstellers
Bei den Punkten 6-8, wird jeweils automatisch ein einzelner Ansprechpartner im Kunden angelegt.
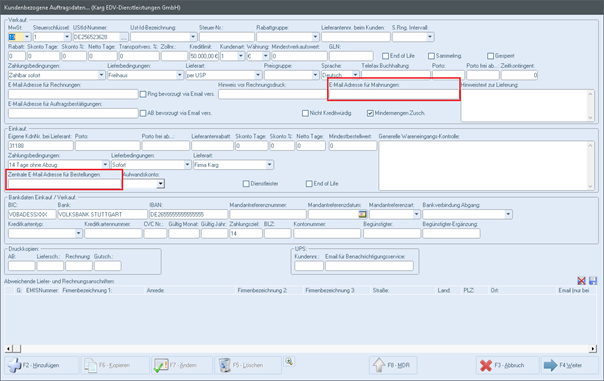
In den kundenbezogenen Auftragsdaten sehen Sie folgende Informationen:
- Im Bereich Einkauf wird eine Zentrale Bestell E-Mail-Adresse hinzugefügt für den Lieferanten
- Im Bereich Verkauf wird das Feld "Rechnung und Mahnung Mail-Adresse" geteilt, dass eine separate Mail-Adresse eingetragen werden kann.
Wichtig hierbei ist, wenn nur eine von Beiden ausgefüllt ist, wird automatisch diese E-Mail-Adresse verwendet. Wenn Beide ausgefüllt sind, wird dies bei der Rechnung und Mahnung unterschieden.
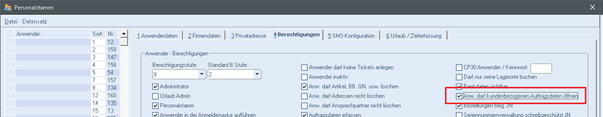
Zudem finden Sie im emis.personalstamm das Recht, ob ein Benutzer die kundenbezogenen Auftragsdaten im emis.crm öffnen darf oder nicht.
Im emis.bestellmodul sowie im emis.cp30 finden Sie ebenfalls die MDR Risikoklasse Erweiterung
Bestell und CP30
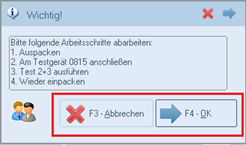
Zusätzlich wurde das emis.bestellmodul sowie emis.cp30 um die MDR Risikoklasse erweitert, dass, wenn die Meldung erscheint, man mit "OK" und "Abbrechen" bestätigen kann.
• Bei "OK" wird im Artikel ein Eintrag im MDR-Protokoll hinzugefügt.
• Bei "Abbruch" wird die Buchung der Position im Bestellmodul abgebrochen bzw. im CP30 der Wareneingang für diese Position.